En 2015, Emmanuelle Charpentier et Jennifer Doudna, deux chercheuses respectivement française et américaine, ont reçu le prix « Breakthrough 2015 in Life Science » pour l’invention d’un outil de génie génétique devenu célèbre dans toute la communauté des sciences de la vie : CRISPR-Cas9.
Le bricolage de l’ADN
Cas9 est une enzyme retrouvée chez un bon nombre de bactéries et qui joue un rôle immunitaire contre des pathogènes de bactéries (par exemple les bactériophages). Cette protéine est capable de dérouler l’ADN d’un corps étranger et de chercher une complémentarité entre une séquence de cet ADN et celui d’un ARN guide porté par Cas9 [1]. Si il y a bien une complémentarité, Cas9 découpe l’ADN invasif au niveau de cette séquence, lui donnant ainsi le nom de « ciseaux moléculaires ». Cette fonction est aujourd’hui exploitée en biologie moléculaire et en génétique, étant une révolution en édition génomique.
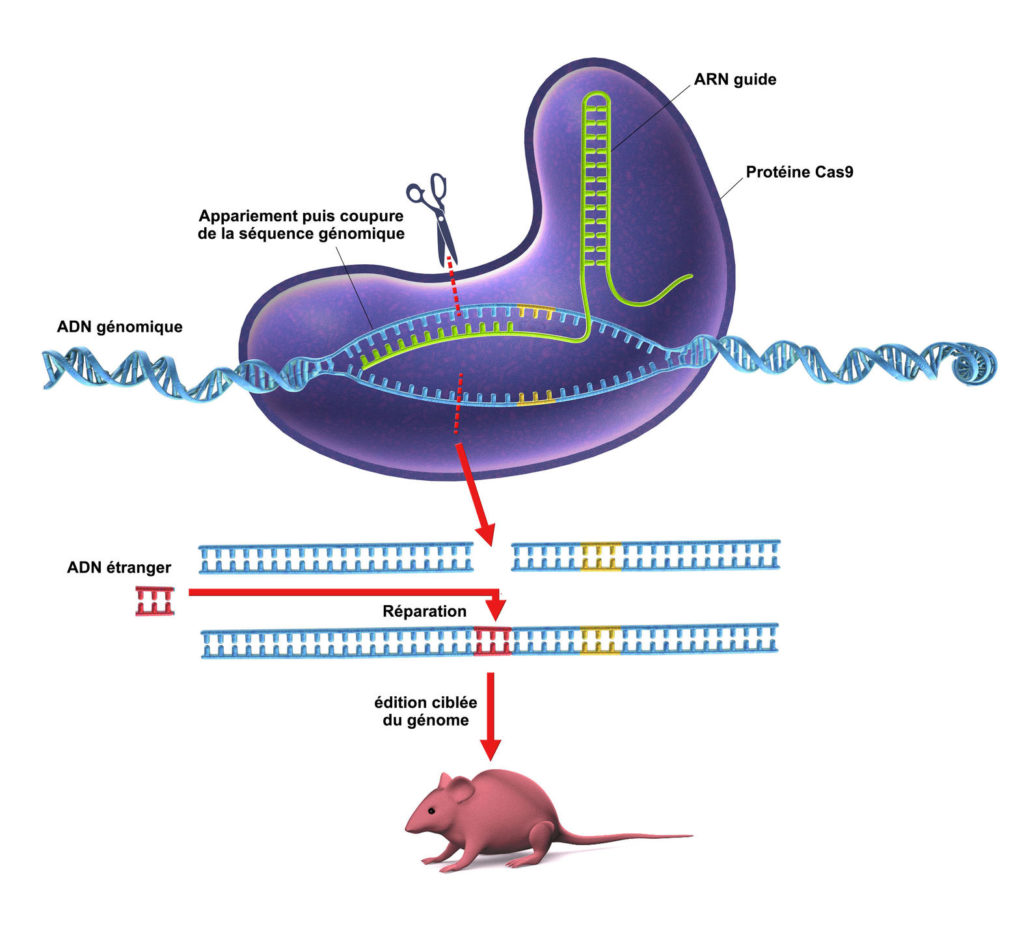
L’ingénierie génétique pour l’édition génomique utilise des « ciseaux moléculaires » appelés nucléases, qui sont des enzymes de restriction sectionnant l’ADN à des emplacements précis, ciblant des gènes en particulier. L’organisme dont l’ADN a été coupé va ensuite subir naturellement un mécanisme de réparation de l’ADN : soit par recombinaison homologue (où une autre séquence d’ADN vient se recoller à l’endroit de la coupure), soit par jonction non-homologue des extrémités (les extrémités de la coupure vont se recoller sans ajout de nouvelle séquence). Ces mécanismes, nos cellules les entreprennent en permanence entre autres pendant leurs divisions afin de réparer les innombrables erreurs qu’elles subissent au niveau de la réplication de l’ADN. Ainsi, il est possible de modifier le génome de l’organisme pour inactiver un gène d’intérêt qui pourrait être responsable d’une pathologie, ajouter un gène de résistance à des maladies etc… Le système CRISPR-Cas9 n’est pas le premier outil utilisé dans l’édition du génome. Depuis les années 80, d’autres techniques étaient utilisées, telles que les méganucléases ou les systèmes ZFN et TALEN [2], mais ne présentaient pas les mêmes avantages que Cas9 en terme de coûts et de spécificité de la séquence ciblée sur le génome. Les molécules utilisées précédemment devaient être conçues spécifiquement pour chaque gène qu’on voulait cibler. Cas9 utilise simplement un ARN guide pour retrouver une séquence de l’ADN dont il est complémentaire : il suffit donc simplement d’adapter la séquence de l’ARN guide à celle de l’ADN qui nous intéresse, coûtant beaucoup moins cher et étant beaucoup plus rapide.
De l’alimentation à la médecine : modifier le génome pour sauver des vies ?
CRISPR-Cas9 trouverait des applications dans l’agronomie, où son utilisation pourrait accroître la production de nouvelles variétés végétales [3]. Les nouvelles techniques d’édition permettront également de répondre à des problèmes de maladies végétales dont sont victimes le riz, le maïs, le blé et bien d’autres, en inscrivant dans leur génome une résistance plus accrue. Dans cette lancée, des résistances aux conditions climatiques et une amélioration des composés nutritifs pourraient voir le jour.
Le système CRISPR-Cas9 ouvre également la voie à la thérapie génique. En 2016, des chercheurs ont réussi à rendre des moustiques résistants au paludisme, ce qui permettrait de réduire la propagation de la maladie chez l’homme après relargage dans la nature. CRISPR-Cas9 pourrait également être utilisé dans la thérapie contre le cancer, Alzheimer et d’autres syndromes génétiques. Il a déjà obtenu des résultats concluants dans des tests de lutte contre le SIDA sur des souris. Depuis 2 ans, les recherches continuent en perspective thérapeutique chez l’Homme, notamment pour le cancer où CRISPR-Cas9 aurait l’avantage de ne pas altérer de cellules saines. Cependant, les résultats obtenus sur l’animal sont difficilement reproductibles chez l’Homme. Le système CRISPR-Cas 9, découvert chez la bactérie Streptococcus pyogenes et dont 65% de la population serait immunisée, pourrait être inefficace voire dangereux en étant responsable de réponses inflammatoires. L’ingénierie moléculaire du système est de mise afin de l’adapter sur un sujet humain.
Quel impact social et sociétal ?
Evidemment, outre les contraintes techniques, l’utilisation d’un outil aussi perfectionné pour éditer un génome révèle des questionnements bioéthiques. En avril 2015, une équipe de chercheurs de Canton auraient annoncé avoir utilisé le système CRISPR-Cas9 pour modifier génétiquement un embryon humain [4]. Les revues Science et Nature auraient par ailleurs refusé l’article qui était soumis par cette équipe pour des problèmes éthiques. Plusieurs académiciens ont pointé du doigt des potentielles dérives, et malgré leur demande d’un moratoire en décembre 2015, bon nombre de bioéthiciens ont soutenu que si il était possible de modifier le génome d’un embryon pour éviter des complications pouvant être fatales par la suite, il fallait le faire [5]. Ainsi, la Grande Bretagne autorisa en 2016 la manipulation génique sur des embryons humains à l’Institut Francis Crick permettant de développer les connaissances sur le développement embryonnaire, notamment via la fécondation in vitro. En 2017, des chercheurs de Portland ont annoncé avoir modifier avec succès un embryon humain ayant possédé des gènes défectueux responsables de maladies héréditaires, mais cet embryon n’a pas été autorisé à se développer plus de quelques jours [6].
 ©Koya79/Istockphoto
©Koya79/Istockphoto
A ce jour, des comités de bioéthique ont pour beaucoup mis en garde la communauté scientifique contre l’utilisation d’outils d’édition du génome chez l’être humain, spécifiquement sur les cellules reproductrices contenant les caractères héréditaires, craignant de tendre vers l’eugénisme (ou « l’être humain à la carte »). Il reste important aujourd’hui de participer aux nombreux débats publics autour de ces questions, qui « par essence, étant éthiques, n’ont pas de réponses absolues », mais touchent à la société et à la santé publique. Mais il est primordial d’avoir les cartes et connaissances en main pour apporter un regard le plus critique sur le sujet, surtout sur un thème aussi complexe que l’édition génomique.
Sources :
[1] Martin Jinek, Krzysztof Chylinski, Ines Fonfara et Michael Hauer, « A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity », Science (New York, N.Y.), vol. 337, no 6096, , p. 816–821
[2] H-G, Cha J, Chandrasegaran, « Hybrid restriction enzymes : Zinc finger fusions to Fok I cleavage domain ». Proceedings of National Academy of Sciences of the United States of America; (2007) 93: 1156-1160
[3] « Le système CRISPR/Cas9 : Pour la compréhension du vivant et l’innovation variétale » , Cécile Collonnier, Jardins de France n° 644
[4] « CRISPR/Cas9-mediated gene editing in human tripronuclear zygotes » , link.springer.com
[5] « CRISPR-CAS9 : QU’EN DISENT LES PREMIERS CONCERNÉS ? » , Généthique –
[6] Steve Connor, « EXCLUSIVE: First human embryos edited in U.S., using CRISPR », MIT Technology Review,
Par Omar El Hamoui – 1er Vice-Président en charge de la médiation scientifique et de l’ouverture culturelle (AFNEUS)
